Alumínio
Para acessar o desenho artístico do elemento alumínio,
clique aqui.
Mapa da chave
13
26,9815
2.450
660
2,70
3
Al
Alumínio
|
 |
|
Alumínio em seu estado
natural. |
Numa exposição
internacional realizada em Paris, em 1855, foram exibidos quatro
grandes blocos de alumínio, que não tinham outra função além da
decorativa. Apesar de ser um dos metais mais abundantes da crosta
terrestre, o alumínio só tinha sido descoberto 28 anos antes e
várias décadas ainda passariam antes de serem desenvolvidos
processos que permitissem sua obtenção industrial em um estado
razoavelmente puro.
O alumínio é um metal
de símbolo Al, branco brilhante, leve, dúctil, maleável, que o ar
altera muito pouco e que apresenta uma estrutura cristalina cúbica
de face centrada, característica de todos os elementos metálicos.
O alumínio é abundante
na natureza, principalmente em forma de silicatos. Sólido, de
densidade 2,7 que funde a 660º C e é um bom condutor de calor e
eletricidade. Em estado puro, é bastante mole e maleável. Embora
seja muito oxidável, não se altera em contato com a água nem com o
ar, pois sua superfície é protegida por uma fina camada de alumina.
É trivalente em seus compostos, como a alumina Al2O3
ou o cloreto AlCl3.
Propriedades físicas
e químicas:
Na ordem decrescente,
de acordo com o peso, dos elementos que constituem a crosta
terrestre, o alumínio ocupa o terceiro lugar, representando cerca de
oito por cento em peso do total. Esse metal faz parte da composição
de grande número de rochas e pedras preciosas; entre as primeiras
cabe mencionar, graças a seu interesse mineralógico ou metalúrgico,
os feldspatos, as micas, a turmalina, a bauxita e a criolita. Entre
as pedras preciosas, aquelas que apresentam um maior teor de
alumínio são o coríndon, as safiras e os rubis.
O alumínio possui altos
índices de condutividade elétrica, e não se altera em contato com o
ar ou em presença de água, graças a uma fina capa de óxido que o
protege de ataques do meio ambiente. Apresenta, entretanto, elevada
reatividade quando em contato com outros elementos: em presença de
oxigênio, sofre reação de combustão, liberando grande quantidade de
calor, e ao combinar-se com halogênios (cloro, flúor, bromo e iodo)
ou com o enxofre, produz imediatamente os respectivos haletos e
sulfetos de alumínio.
Descoberta e
aplicações:
Desde épocas remotas,
já se sabia existir no alúmen (sulfatos duplos de metais) e em
outros minerais um metal de características específicas. Entretanto,
somente em 1825, o dinamarquês Hans Christian Örsted isolou o
alumínio, através da redução do cloreto de alumínio em uma amálgama
de potássio. Posteriormente, outros químicos realizaram diversas
experiências que permitiram um estudo mais preciso das propriedades
desse metal. Destacam-se nesse sentido os trabalhos do alemão
Friedrich Wöhler, que conseguiu obter pós e glóbulos de alumínio
puro.
A moderna produção de
alumínio teve início em 1886, graças a esforços simultâneos do
francês Paul-Louis-Toussaint Héroult e do norte americano Charles
Martin Hall com o processo desenvolvido, quase simultaneamente. Esse
procedimento favorecido pela difusão do uso da energia elétrica,
consistia em submeter massas de alumina (óxido de alumínio)
purificada, dissolvidas em criolita fundida, ao processo de
eletrólise (decomposição de substâncias em solução pela passagem de
corrente elétrica).
É nos países com
elevado grau de industrialização que se concentra a maior parte das
variadas aplicações do alumínio. A maior parte da produção mundial
destina-se às indústrias aeronáutica e automobilística.
Outra importante área
de aplicação do alumínio é a fabricação do arame, tanto usando o
metal puro ou ligas. Com o alumínio são fabricados cabos de
transmissão de eletricidade, através de processos de trefilação. Por
medida de segurança esses fios são freqüentemente recobertos por uma
capa isolante flexível, geralmente de borracha. Também é usado,
devido a sua grande condutibilidade térmica e elétrica e condutores
para eletrotécnica, condensadores e refletores.
As ligas de alumínio
apresentam propriedades importantes, principalmente no que diz
respeito a sua facilidade de manipulação e deformação plástica. Como
conseqüência, são amplamente empregadas na fabricação de parafusos,
peneiras pinos, dobradiças, etc. Essas características delimitam
outro dos grandes campos de aplicação do alumínio e suas ligas, o
dos materiais de construção. Assim é comum a utilização desse metal
no revestimento de fachadas e na fabricação de janelas. O alumínio é
também empregado por sua resistência ao ar e a certas corrosões
freqüentes em folhas e placas, embalagens dos mais diversos tipos,
certas coberturas; atende indústrias químicas, farmacêuticas e
alimentícias.
Industrialização do
alumínio:
A adaptação das peças
de alumínio à forma e à textura adequadas para cada uma de suas
muitas aplicações obriga à utilização de uma série de operações
industriais.
O principal processo de
tratamento do alumínio é a laminação, cujo fundamento é a redução ou
modificação da espessura de uma peça metálica através de sua
compressão em equipamentos especiais denominados laminadores. Outro
processo habitual utilizado para a conformação do alumínio é a
extrusão, através da qual o metal, em estado semi-sólido, passa
através de um molde vasado, de forma e dimensões semelhantes.
Há também, a elaboração
do metal a partir de seu principal minério, a bauxita (à base
de óxido de alumínio), que efetua-se industrialmente em duas fases
sucessivas:
1. Obtenção de
alumina pura, como o minério atacado por soda, precipitação e
eliminação das impurezas, lavagem e calcinação, segundo o processo
Bayer.
2. Eletrólise ígnea da
alumina em solução de fluoreto duplo de alumínio e sódio (criolita),
fundindo a 950º C, num forno elétrico de cuba, com ânodos de carbono
(coque, grafite). O alumínio é recolhido com cátodos, no fundo da
cuba, apresenta um título de 99,8%; após obter alumínio de
extraordinária pureza, com título de 99,995%.
Ligas de alumínio:
As ligas de alumínio
são bastante utilizadas em diversas aplicações industriais, graças a
sua elevada resistência e solidez. O cobre, o magnésio e o silício
são alguns dos elementos que mais se apresentam a formar liga com o
alumínio. Esse tipo de combinação, de que existem inúmeras
variedades, é a chamada liga leva. Entre as de maior interesse
industrial, cabe mencionar o duralumínio (de Düren), formado por
93,2 a 95,5% de alumínio, 3,5 a 5,5% de cobre, 0,5 a 0,8% de
magnésio e, em alguns tipos, silício; as ligas de alumínio e
magnésio empregadas na construção naval, graças a sua elevada
resistência à corrosão e soldabilidade; e as ligas de alumínio e
silício, que desempenham papel importante na indústria
automobilística, devido a sua elevada resistência mecânica e peso
reduzido, assim como na fabricação de componentes elétricos.
A tradicional liga de
alumínio, o duralumínio (conhecida também como
alumínio-cobre-magnésio), pode ser endurecida por um tratamento
estrutural (maturação ou envelhecimento) que a torna utilizável na
fabricação de automóveis e aviões. Outras ligas, com cobre-níquel,
com magnésio (alumig), com magnésio-zinco (zicral), sofrem
igualmente esse tratamento térmico característico. Em forma de peças
de fundição, a liga de alumínio-silício (alpax) é utilizada na
produção de blocos de motores de êmbolos de automóveis.
Para se obter essas
ligas é necessário utilizar um alumínio de alta pureza, requisito
que tem levado ao desenvolvimento de diversos processos de obtenção
desse metal, todos baseados na redução da alumina extraída da
bauxita, o mais abundante minério de alumínio.
Economia e produção:
Para se descrever a
distribuição geográfica dos produtos relacionados à industrial do
alumínio é necessário distinguir claramente entre a produção de
bauxita e a do próprio metal, em primeira ou segunda fusão, de
acordo com o grau de pureza.
A produção do alumínio
purificado está estreitamente vinculada ao nível econômico das
regiões beneficiadoras de bauxita. Muito importantes como fatores
infra-estruturais são os recursos hidráulicos e energéticos da
região e a capacidade de recuperação dos resíduos produzidos no
processo de obtenção desse metal. Em fins do século XX,
os principais produtores do alumínio refinado eram os Estados
Unidos, seguidos por Canadá, Austrália, Brasil e Alemanha.
No Brasil, começaram em
1938 as pesquisas para produção de alumina, e em 1945 entrou em
operação uma fábrica da Eletro-Química Brasileira. Paralisada dos
anos depois, a fábrica reiniciou suas atividades em 1951, adquirida
pelo grupo canadense da Alcan, passando a chamar-se Alumínio Minas
Gerais. Em 1955, surgiu uma segunda empresa, a CBA, do grupo Ermírio
de Morais. Nos 15 anos seguintes, as duas empresas supriram menos de
cinqüenta por cento da demanda interna. Em 1970 surgiu a Companhia
Mineira de Alumínio, controlada pelo grupo americano Alcoa e em 1979
a produção brasileira foi de 1.666.997 toneladas.
Além das jazidas de
bauxitas já localizadas, principalmente em Poços de Caldas - MG,
descobriram-se no Pará riquíssimas reservas: cerca de 400 milhões de
toneladas no projeto Jari; cerca de 600 milhões junto ao rio
Trombetas (Mineração Rio do Norte, controlada pela Companhia Vale do
Rio Doce, com participação de empresas privadas nacionais e
estrangeiras); e ainda uma importante jazida na serra de Carajás.
A produção mundial (de
primeira fusão) aproxima-se hoje dos 13 de toneladas por ano, tendo
mais que quadruplicado nas duas últimas décadas, embora seu ritmo de
crescimento já há alguns anos decresça. A geografia da produção não
coincide exatamente com a da extração da bauxita, a matéria-prima.
Alimentando indústrias sofisticadas, requerendo grandes quantidades
de eletricidade (12 a 15kWh por quilo de metal), fator essencial da
implantação das usinas de eletrólise, a produção de alumínio toca
sobretudo aos países altamente desenvolvidos. Os EUA fornecem
quase 1/3 da produção mundial; a Rússia,
1/6. Vêm depois o Japão e o Canadá, seguidos pelo
bloco de países da Europa ocidental, s Noruega (que dispõe de
abundantes recursos hidrelétricos), a Alemanha Ocidental, a França e
a Grã-Bretanha.
Atualmente, a indústria
brasileira de alumínio apresenta considerável relevância, sendo
responsável por cerca de 3,9% das exportações do país e 2,8% do
produto interno bruto industrial.
|
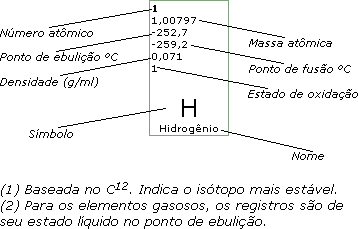
Propriedades físicas e químicas do alumínio:
|
|
Número atômico: |
13 |
|
Peso atômico: |
26,9 |
|
Ponto de fusão: |
660º C |
|
Ponto de
ebulição: |
2.467º C |
|
Densidade: |
2,7 |
|
Gravidade
específica: |
Rede cúbica de
face centrada |
|
Raio atômico: |
1,43 Å |
|
Estados de
oxidação: |
+3 |
|
Configuração
eletrônica: |
1s22s22p63s23p1 |

