Chumbo
Para acessar o desenho artístico do elemento chumbo,
clique aqui.
Mapa da chave
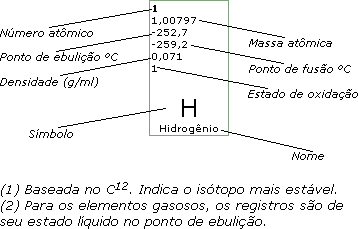
82
207,19
1.725
327,4
11,4
4,2
Pb
Chumbo
|
 |
|
Amostra de chumbo. |
Os alquimistas
acreditavam que o chumbo era o mais antigo dos metais e o associavam
ao planeta Saturno: saturnismo, ainda é hoje, é o envenenamento por
inalação ou ingestão de sais de chumbo.
Chumbo é um elemento
químico do grupo dos metais. Maleável e resistente, é mau condutor
de eletricidade. Seu número atômico é 82 e o símbolo químico é Pb,
derivado do latim plumbum. Tem uma vasta gama de aplicações e
é um dos metais utilizados no mundo.
O uso do chumbo remonta
a 5.000 a.C., com os egípcios, que o utilizavam para a cunhagem de
moedas e fabricação de cosméticos. Os jardins suspensos da
Babilônia, construídos em 600 a.C., tinham calhas de chumbo para
manter a umidade. Os gregos exploravam as jazidas de chumbo de
Laurium no quinto século a.C., e os romanos fabricaram canos de
chumbo no século III
a.C. Na idade média, usou-se o chumbo para armar os vitrais das
igrejas, e em calhas, escoadouros, encanamentos e nos tetos das
catedrais, mosteiros e castelos. O chumbo foi também usado na
guerra, graças ao baixo ponto de fusão, para lançá-lo derretido
sobre os invasores, e à densidade, para fabricação de balas de
canhão e outros projéteis.
A produção de chumbo
acentuou-se no século XIX,
quando aumentaram suas aplicações industriais. Metais leves e
resistentes, como o titânio, vieram substituí-lo, com a conseqüente
queda no volume de produção. Entre os compostos de chumbo destaca-se
o mínio, empregado como protetor do ferro contra corrosão. O chumbo
é empregado como protetor de tubulações e cabos subterrâneos
condutores de eletricidade. Não deve entretanto ser empregado para
conduzir água. Para absorver radiações de ondas curtas, é usado como
protetor de reatores nucleares, aceleradores de partículas e
equipamentos de raios X e transporte e armazenagem de material
radioativo.
Numerosos sais de
chumbo têm as diversas aplicações: o amarelo e o vermelho de cromo
como corantes e pigmentos; o monóxido de chumbo, ou litargírio, na
fabricação do vidro, na vulcanização da borracha, e como componente
de esmaltes vítreos; o dióxido de chumbo nas placas positivas de
baterias elétricas; o carbonato de chumbo fornece alvaiade.
Obtenção e produção:
A principal fonte de
chumbo é a galena, cuja mineração visa também o aproveitamento de
outros metais a ela associados, como prata, ouro, zinco, cádmio,
bismuto, arsênio e antimônio. Como os minérios de chumbo — galena,
cerusta e aglesita — são de composição extremamente variável,
existem diversas técnicas de mineração. A galena, que normalmente
contém 86,6% de chumbo, está sempre misturada a outros metais.
O minério é preparado
por ustulação (aquecimento do ar), para separação do enxofre, quando
o sulfeto de chumbo converte-se, pela volatilização do dióxido de
enxofre, em dióxido de chumbo. Pela fusão, o óxido de chumbo é
reduzido em alto forno, ao qual se adicionam o coque, um fundente e
o óxido de ferro. O produto obtido, chamado chumbo bruto, ou chumbo
de obra, é separado dos demais elementos (mate escória) por
diferença de densidade dos produtos no cadinho. Em seguida, é
submetido a refinação, para remoção das impurezas metálicas, por
refinação ou por destilação. O chumbo obtido por esse processo pode
apresentar teor de pureza de 99,999%. A produção mundial de chumbo
concentra-se nos Estados Unidos, Austrália, Canadá, Peru e México.
Algumas jazidas do norte e sudoeste da África aumentaram muito a
produção no final do século XX.
Quase todo o chumbo produzido é consumido pelos Estados Unidos e
Europa. Tomando como base de cálculo a tonelagem de metal refinado,
o chumbo ocupa o quinto lugar dentre os metais depois do ferro,
alumínio, cobre e zinco.
No Brasil, a produção
iniciou-se na Bahia, ainda hoje o maior produtor do país, vindo em
seguida São Paulo e Paraná. Os minérios de chumbo brasileiros,
principalmente a galena, apresentam alto teor de prata (cerca de
2,5kg para uma tonelada de chumbo refinado). Ao final do século XX,
estimava-se que a produção brasileira seria suficiente para atender
à demanda interna.

